Catálisis Enantioselectiva
¿Sabía que el responsable del sabor dulce y amargo en los cítricos es la misma molécula? ¿Qué la mayoría de las moléculas útiles para la vida presentan una curiosa propiedad llamada quiralidad? ¿Qué el mentol tiene 8 formas posible y sólo una posee las propiedades que todos conocemos?
¿QUÉ ES UN CATALIZADOR?
Un catalizador es una sustancia que incrementa la velocidad a la que se produce una reacción química sin consumirse en la reacción. Este hecho tiene una gran importancia desde un punto de vista industrial. La catálisis es crucial para la industria química. Los catalizadores permiten que las reacciones químicas se produzcan con velocidades lo suficientemente altas como para que sean viables industrialmente, o en condiciones experimentales menos exigentes. En este campo, es de especial importancia la catálisis enantioselectiva, en especial en la industria farmacéutica, puesto que los seres vivos somos muy selectivos a la hora de distinguir enantiómeros.
LA QUIRALIDAD

Si nos miramos a un espejo descubriremos que, en apariencia, tenemos un plano de simetría que relaciona las dos mitades de nuestro cuerpo: tenemos dos ojos uno a cada lado, dos brazos, dos piernas, una nariz bien colocada en medio... Esta simetría da lugar a una propiedad que se pone de manifiesto si observamos nuestras manos. Son simétricas, una es la imagen especular de la otra, pero no son idénticas: no podemos superponerlas, los guantes no son intercambiables. Esta propiedad se llama quiralidad.
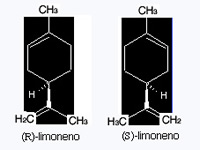
En el mundo de las moléculas nos encontramos con multitud de ellas que presentan esta propiedad, muchas más de las que pueda parecer. Una molécula y su imagen especular no son superponibles es decir, como nuestras manos, no son idénticas. Muchas de estas moléculas tienen actividad biológica: aminoácidos, proteínas, aromas, esencias, medicamentos, fungicidas, herbicidas, pesticidas,... Presenta, pues, la propiedad llamada quiralidad y se dice que son quirales. Una molécula quiral es, por ejemplo, la que da el olor a naranja. La molécula responsable es el (R)-limoneno; lo curioso es que su imagen especular, el (S)-limoneno, huele a limón. La notación (R) ó (S) se emplea para distinguirlas. Son dos compuestos isómeros y se llaman enantiómeros.
SÍNTESIS ENANTIOSELECTIVA
Entre las moléculas quirales las más relevantes quizá sean los fármacos. Un gran número de ellos son quirales, porque nuestra propia bioquímica también lo es. Cuando una molécula posee dos enantiómeros, en muchas ocasiones, sucede que sólo uno tiene la actividad biológica deseada, pues los receptores del organismo sólo pueden interactuar con uno de ellos. El problema surge cuando se quiere sintetizar la molécula: si no se ponen los medios adecuados se obtienen los dos enantiómeros en una mezcla al 50% de cada uno de ellos; se obtiene lo que se llama una mezcla racémica. Lo difícil es en separar el útil del que no lo es, pues ambos tienen idénticas la gran mayoría de sus propiedades: son el mismo compuesto en el que los átomos se han colocado formando dos agrupaciones diferentes en el espacio. La síntesis enantioselectiva, obtener uno sólo de los enantiómeros, no es fácil de hacer. Una forma de obtener los compuestos con la quiralidad deseada es emplear materiales de partida naturales que ya la posean y conservarla durante el proceso de síntesis. Otra estrategia ha sido desarrollar reactivos quirales para diferentes tipos de reacciones, que permitan introducir la quiralidad deseada en el producto obtenido. Para obtener enantiómeros puros es necesario emplear "medios quirales" porque sólo en ellos los enantómeros manifiestan sus diferencias; si no trabajamos en un medio quiral, son indistinguibles.
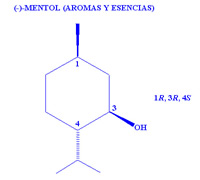
El boom de la catálisis enantioselectiva sucedió en los años setenta del siglo pasado. A partir de los trabajos de William S. Knowles sobre un tipo de catalizadores (dicho técnicamente, catalizadores de hidrogenación basados en metales de transición en los que se incluyó como ligando fosfinas quirales), le llevaron a desarrollar la primera síntesis asimétrica catalítica industrial, la de la L-DOPA. Este aminoácido se utiliza en el tratamiento del Parkinson, y la compañía Monsanto ha venido utilizando este proceso desde 1974. Tras este éxito, un grupo de investigadores dirigido por R. Noyori siguió por ese camino y en 1984 la empresa Takasago puso en funcionamiento una planta destinada a sintetizar el mentol, utilizado como aroma. Desde siempre los chinos lo han extraído de la planta Mentha arvensis, y aún se sigue produciendo. De hecho, el mentol tiene 8 isómeros y de todos ellos sólo uno tiene las propiedades que conocemos. Desde entonces sintetiza cerca de la mitad del mentol producido en todo el mundo. W. S. Knowles, R. Noyori y K. B. Sharpless recibieron en 2001 el Premio Nobel de Química por sus trabajos en este campo.
Hoy en día hay numerosos compuestos enantioselectivos con aplicaciones en muchos campos de nuestras vidas. Además de ejemplos de fármacos, podemos encontrarlos como insecticidas o fungicidas. Como hemos visto en los ejemplos anteriores, generalmente, solamente nos interesan las propiedades de uno de los enantiómeros, ya que el otro o no presenta esa propiedad deseada o en una proporción mucho menor por lo que es necesario mucha más cantidad de compuesto para alcanzar los mismos resultados. Por este motivo conseguir la preparación selectiva de uno de los compuestos es de gran interés. Este es un campo de investigación totalmente abierto puesto que en más de la mitad de los casos todavía no se ha podido lograr preparar solamente uno de los enantiómeros.
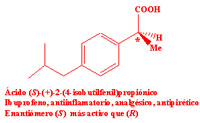
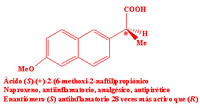
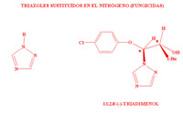
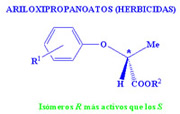
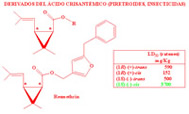
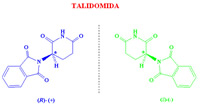
Dada esta dificultad que supone separar dos enantiómeros, hasta hace unos años los medicamentos quirales se administraban habitualmente como mezclas racémicas, aunque la actividad terapéutica residiese en uno sólo de los enantiómeros. Este hecho provocó uno de los ?desastres? farmacológicos más importantes del siglo XX. Entre 1959 y 1962 se administró talidomida a mujeres embarazadas como sedante y contra las náuseas, durante los primeros meses de gestación. Las propiedades deseadas se encontraban en la (R)-talidomida, pero se administraba la mezcla racémica. Sin embargo, lo que se desconocía era que la (S)-talidomida es teratogénica, produce malformaciones fetales, algo que pasó desapercibido hasta que empezaron a nacer los niños. Investigaciones posteriores descubrieron que, además, a pH fisiológico la molécula se racemiza, esto es, la (R)-talidomida se convierte parcialmente en (S)-talidomida: tampoco el enantiómero sedante debe suministrarse.
¿QUÉ HACEMOS EN EL ICMA?

En el ICMA pretendemos descubrir métodos para generar compuestos enantiómeros puros mediante catálisis: un catalizador interacciona con A y facilita que A reaccione con B, se forma AB que se recoge como producto, se regenera el catalizador y A comienza un nuevo ciclo. Recordemos que para obtener compuestos enantioméricamente puros se tiene que utilizar algo quiral, y eso es caro, pues no es fácil obtenerlo. Empleando catalizadores quirales reducimos los costes ya que con una pequeña cantidad de catalizador podemos obtener grandes cantidades del producto quiral final El tipo de catálisis que investigamos se llama catálisis homogénea. Esto es, que tanto los reactivos como el catalizador se encuentran en la misma fase, habitualmente líquida. El problema con ello es que resulta difícil recuperar el catalizador. Una de las metas que nos hemos marcado en el ICMA es conseguir recuperar el catalizador y, de hecho, hemos logrado reutilizarlo, en algunas ocasiones, hasta 4 veces, sin perder actividad, algo que no es fácil de lograr. La mayoría de los catalizadores se basan en metales preciosos: rodio, iridio, rutenio, osmio... El rodio, por ejemplo, es más caro que el platino. Ahora bien, lo más caro no es el metal, sino lo que se llama el ligando quiral, la parte quiral que se une al metal para que tenga las propiedades que buscamos.
Si quieres más información...

Catalizadores que aceleran el proceso de fabricación de nuevos fármacos
Catálisis: la Química más limpia y sencilla










